Anhand des durchgeführten Versuches sollte die Frage geklärt werden, ob mit einem sauberen Gummihandschuh aus der Transportverpackung entnommene Pipettenspitzen und Reaktionsgefäße Sterilität aufweisen. Die Frage stellt sich vor dem Hintergrund einer Zeitersparnis bei den Versuchsvorbereitungen für den Lehrer, da diese Materialien nicht mehr autoklaviert werden müßten.
Auf LB-Agarplatten wurden mit einer Pipettenspitze, die mit einem sauberen
Gummihandschuh aus der Transportverpackung herausgenommen wurde, 100 µl LB-Medium
pipettiert und ausgestrichen.
Auf die gerade beschriebene Art und Weise wurden ebenfalls Reaktionsgefäße aus der
Transportverpackung entnommen und mit LB-Medium gefüllt. Aus den mit LB-Medium gefüllten
Reaktionsgefäßen wurden dann mit autoklavierten Pipettenspitzen wiederum 100 µl
LB-Medium auf LB-Agarplatten gegeben und ausgestrichen.
Für die Versuchsansätze wurden Materialien aus jeweils zwei unterschiedlichen, kurz
vor Versuchsbeginn geöffneten Verpackungen entnommen. Als Kontrollen dienten
LB-Agarplatten mit ausgestrichenem LB-Medium, wo jeweils nur mit zuvor autoklavierten
Materialien gearbeitet wurde. Das Autoklavieren erfolgte nach herkömmlicher Methode bei
121 °C und 1 bar Überdruck für 20 Minuten.
Versuchsansätze und Kontrollen, die doppelt angesetzt wurden, sind dann für 24 h bei
37 °C inkubiert worden.
Die Auswertung des Versuches erfolgte unter dem Gesichtspunkt, ob Bakterien- oder
Pilzwachstum auf den Platten zu sehen war.
Die Ergebnisse sind in Tabelle 25 dargestellt und lassen sich wie folgt zusammenfassen:
Auf keiner der Versuchsplatten war nach 24stündiger Inkubation bei 37 °C weder Bakterien,
noch Pilzwachstum festzustellen. Bei den mitgelaufenen Kontrollansätzen war
erwartungsgemäß ebenfalls kein Wachstum festzustellen.
| Material | LB-Agarplatte | Wachstum (Bakterien und/oder Pilze) |
| Pipettenspitzen | ||
| direkt aus Verpackung |
A1 |
negativ |
|
A2 |
negativ |
|
|
B1 |
negativ |
|
|
B2 |
negativ |
|
| Kontrolle |
negativ |
|
| Reaktionsgefäße | ||
| direkt aus Verpackung |
A1 |
negativ |
|
A2 |
negativ |
|
|
B1 |
negativ |
|
|
B2 |
negativ |
|
| Kontrolle |
negativ |
Die gewonnenen Ergebnisse zeigen, daß die aus einer Transportverpackung mit einem Gummihandschuh entnommenen Materialien Sterilität aufweisen (Tab. 25). Das hängt wohl in allererster Linie mit der maschinellen Verpackung solcher Materialien zusammen. Für Schulen hat das gewonnene Versuchsergebnis zur Konsequenz, daß aus der Transportverpackung entnommene Materialien für Versuche nicht vorher sterilisiert werden müssen. Allerdings wurden die Versuche mit Materialien aus erst kurz vor Versuchsbeginn geöffneten Verpackungen durchgeführt, d.h. Versuche mit Materialien aus bereits seit längerer Zeit offenen Beuteln sind nicht durchgeführt worden. In Schulen ist das Problem natürlich nicht ganz unerheblich, da wohl kaum der Inhalt einer Verpackung im Zuge eines Einzelversuches verbraucht wird. Da keine Untersuchungsergebnisse zur Sterilität von Materialien aus länger geöffneten Verpackungen vorliegen, ist für Schulen das Autoklavieren solcher Materialien zu empfehlen.
Das Bakterium E. coli teilt sich unter optimalen Wachstumbedingungen alle 20 Minuten. Für ein optimales Wachstum von E. coli-Zellen in einer Flüssigkultur sind mehrere Faktoren verantwortlich. Neben einer ausreichenden Nährstoffversorgung und einem Temperaturoptimum von 37 °C muß für eine ausreichende Sauerstoffversorgung der Kultur gesorgt werden. Dieses geschieht in der Regel durch Belüftung der Kultur mit Hilfe eines sogenannten Schüttlers oder eines Rollrades. Nun kann in Schulen weder das Vorhandensein eines Schüttlers bzw. Rollrades noch die Existenz eines 37 °C warmen Brutschrankes oder Wasserbades mit Schütteleinrichtung vorausgesetzt werden. Die Frage war, welche Alternativen Schulen angeboten werden können, die das Schülerexperiment trotzdem durchführen möchten. Dafür wurden die Verwendung einer Aquarienpumpe und über einen Schlauch eingeleitete Druckluft als alternative Belüftungsmöglichkeiten überprüft. Darüber hinaus sollte die Frage geklärt werden, ob bei Raumtemperatur gehaltene und genügend belüftete Flüssigkulturen eine ausreichende Zellzahl für die Plasmidpräparation ergeben.
Bei den verwendeten Bakterien handelt es sich um E. coli DH5a
, die das Plasmid pBR322 beinhalten. Die verwendeten Materialien und Methoden sind mit den
im Lehrermanual zur Plasmidpräparation (Kapitel 5.1.2) für das Ansetzen einer
Flüssigkultur und die Plasmidpräparation erwähnten identisch.
Es wurden insgesamt 5 Reagenzgläser mit jeweils 7 ml LB-Medium angeimpft. Diese sind dann
auf unterschiedliche Weise belüftet und entweder bei Raumtemperatur oder in einem
Brutraum bei 37 °C für 19 h inkubiert worden.
Die Versuchsansätze, bei denen die alternativen Belüftungmöglichkeiten untersucht
wurden, waren so präpariert, daß über eine in die Nährflüssigkeit eintauchende
sterile Pasteurpipette die Luftzufuhr gewährleistet war. Die Pasteurpipette hatte über
einen Gummischlauch Anschluß an die Luftquelle. Abgedichtet wurde das Reagenzglas mit
Alu-Folie.
Die Bakteriendichte in den Reagenzgläsern wurde nach 19stündiger Inkubation anhand des
Trübungsgrades des bei Versuchsbeginn klaren LB-Mediums optisch abgeschätzt, wobei
zwischen geringer (+), mittlerer (++) und starker (+++) Trübung unterschieden wurde.
Die Ergebnisse zur Bakteriendichte und die Resultate aus den Plasmidpräparationen sind in Tabelle 26 dargestellt.
|
Ansatz |
Belüftung |
Inkubation |
Trübungsgrad |
Plasmid |
Ges.konz. Plasmid-DNA (ng/µl) |
|
1 |
Druckluft |
Raumtemperatur |
++ |
pBR 322 |
~ 5 |
|
2 |
Druckluft |
Raumtemperatur |
++ |
pBR 322 |
~ 5 |
|
3* |
Druckluft |
Raumtemperatur |
Medium verdunstet |
pBR 322 |
- |
|
4 |
Aquarienp. |
37 °C |
++ |
pBR 322 |
~ 5 |
|
5 |
Rollrad |
37 °C |
+++ |
pBR 322 |
~ 7,5 |
Aus den auf alternative Weise belüfteten Versuchsansätzen konnte bei der
anschließenden Plasmidpräparation eine für die weiteren Experimente ausreichende Menge
Plasmid-DNA gewonnen werden (Tab. 26). Diese ist zwar geringer als bei dem unter optimalen
Wachstumsbedingungen durchgeführten Versuchansatz (Ansatz 5), liefert aber bei einem
Gesamtvolumen von 50 µl ein ausreichendes Quantum an Plasmid-DNA für eine
Restriktionsspaltung, eine gelelektrophoretische Auftrennung und eine abschließende
Transformation.
Des weiteren belegen die Resultate, daß der Einfluß der Temperatur auf das
Bakterienwachstum nicht so entscheidend ist. Die Ergebnisse der Versuchsansätze 1 und 2
(Druckluft/ Raumtemperatur) entsprechen hinsichtlich des Trübungsgrades der
Bakterienkultur und der erzielten Plasmidausbeute den Resultaten des 4. Versuchsansatzes
(Aquarienpumpe/ 37 °C). Unter Berücksichtigung der Ergebnisse der Kontrolle
(Versuchsansatz 5), bei denen optimale Bedingungen für das Wachstum der Bakterienkultur
geschaffen wurden, läßt sich folgern, daß die Belüftungsverhältnisse einen stärkeren
Einfluß auf das Bakterienwachstum haben als die Temperatur in den untersuchten Bereichen
(37 °C und Raumtemperatur).
Als Konsequenz aus dem Versuchsansatz 3, wo das komplette Medium nach 19stündiger
Inkubation verdunstet war, ist bei den alternativen Belüftungsmaßnahmen darauf zu
achten, daß die Pasteurpipette immer ins Medium eintaucht.
Für Schulen bedeuten die ermittelten Versuchsergebnisse, daß der Rückgriff auf alternative Belüftungsmethoden möglich ist und für das Bakterienwachstum Raumtemperaturen bei ausreichenden Belüftungsverhältnissen genügen. Druckluftanschlüße sind in den naturwissenschaftlichen Fachräumen von Schulen vorhanden. Falls das nicht der Fall sein sollte, kann die angesprochene Aquarienpumpe ebenso gute Dienste leisten.
Es bleibt für Schulen aber auch zu überlegen, ob sie sich nicht mit anderen Mitteln weiterhelfen können. Z.B. könnte man mit Materialien von „Fischertechnik" ein Rollrad selber bauen. Hinweise für den Bau eines Brutschranks und einer Schütteleinrichtung mit Wasserbad aus preiswerten Materialien sind bei BAYRHUBER/ LUCIUS (Bd.1, 1992) zu finden.
In den Experimenten müssen kleinste Volumina pipettiert werden. Im Laboralltag werden
dafür spezielle Pipettierhilfen benutzt. An ihnen kann das gewünschte Volumen
voreingestellt und so problemlos pipettiert werden. Der Nachteil an diesen
Mikropipettierhilfen ist der verhältnismäßig hohe Anschaffungspreis, der es Schulen
kaum ermöglichen wird, solche Geräte im Klassensatz anzuschaffen.
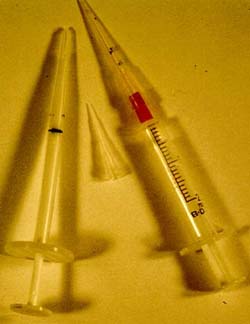
Abhilfe kann für die Schule geschaffen werden, indem sie auf preiswertere Alternativen
zurückgreift. Eine Auswahl ist in Abbildung 11 dargestellt.
Die Handhabung der alternativen Mikropipetten ist relativ leicht und läßt sich von
Schülern in einer den eigentlichen Experimenten vorgeschalteten Phase schnell erlernen.
Die weißen Spitzen sind vom Hersteller bereits mit Markierungen versehen, mit denen sich
Volumina von 2 und 10 µl relativ exakt pipettieren lassen. Für größere Volumina kann
man gelbe Spitzen verwenden. Allerdings befinden sich dort keine Markierungen für
bestimmte Flüssigkeitsmengen. Eine ziemlich genaue Markierung kann dadurch festgelegt
werden, indem man auf einer separaten Spitze Markierungen vornimmt. Mit Hilfe einer
voreinstellbaren Mikropipettierhilfe können bestimmte Volumina von Flüssigkeiten (z.B.
Wasser) pipettiert und im aufgezogenen Zustand die Spitze an der betreffenden Stelle
gekennzeichnet werden. Diese so gekennzeichnete Spitze kann als Referenzspitze für die
anderen Spitzen dienen. Dafür ist natürlich das Vorhandensein zumindest einer
Mikropipettierhilfe an Schulen erforderlich. Das kann zum Beispiel in Form einer Leihgabe
geschehen. Das Institut für Genetik der Universität zu Köln hat sich dazu bereit
erklärt. Ferner könnten Lehrer ortsansässige Chemie-, Biotechnologie- und
Pharmaunternehmen bezüglich Leihgaben ansprechen.
 | Als große Abbildung |
Anhand der Ergebnisse aus den mit diesen Plasmiden durchgeführten Versuchen (Kapitel 6.1 bis 6.7) soll hier ihre Verwendbarkeit im Schülerexperiment kurz diskutiert werden.
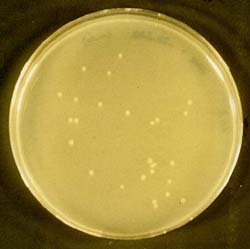
Die Abbildung 12 zeigt eine Agarplatte auf der sich mit pBR322 transformierte E. coli K12 DH5a befinden.
 | Als große Abbildung |
Die mit dem Plasmid erzielten Ergebnisse bei Plasmidpräparation (Kapitel 6.1), Restriktion (Kapitel 6.2), gelelektrophoretischer Auftrennung (6.3) und Transformation (Kapitel 6.4) erlauben es, daß das Plasmid im Schülerexperiment zur genetischen Transformation verwendet werden kann.
Genau wie der Plasmid-Vektor pBR322 kann das Plasmid uneingeschränkt aufgrund guter
Erfahrungen in durchgeführten Experimenten für das Schülerexperiment empfohlen werden
(Kapitel 6.1 - 6.5). Dabei ist darauf hinzuweisen, daß mit dem Plasmid transformierte E.
coli DH5a-Zellen zur a
-Komplementation fähig sind und diese auf McConkey-Agarplatten anhand einer spezifischen
Rotfärbung identifiziert werden können (Abb.10, S. 127).
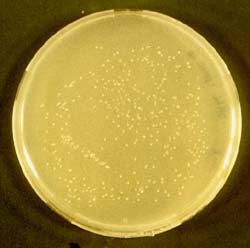
In Abbildung 13 sind mit pUC 19 transformierte E. coli-Zellen vom Stamm DH5a zu sehen.
 | Als große Abbildung |
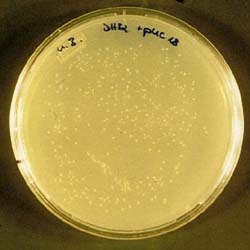
Bezogen auf eine Empfehlung für das Schülerexperiment gilt das für den Plasmid-Vektor pUC 19 (Kapitel 6.9.2) gesagte im gleichen Maß für pUC 18.
 | Als große Abbildung |
Die Abbildung 14 zeigt eine Agarplatte, auf der sich mit pUC 18 transformierte E. coli K12 DH5a befinden.
Die mit dem Plamid erzielten Ergebnisse bei durchgeführten Versuchen (Kapitel 6.1 - 6.5) entsprechen denen, die mit den Plasmid-Vektoren pBR322 und pUC 18 bzw. pUC 19 erreicht werden konnten. Die Abbildung 15 zeigt eine Agarplatte, auf der sich mit dem Plasmid pAmp transformierte E. coli K12 DH5a befinden.
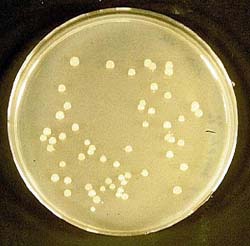 | Als große Abbildung |
Das Problem bei diesem Plasmid ist die Beschaffung. Vertrieben wird das Plasmid
ausschließlich über die in den USA ansässige Carolina Biological Supply Company. Der
Preis für das Plasmid beträgt zzgl. Versandkosten ca. US-$ 27.
Aufgrund des relativ hohen Aufwandes bei der Beschaffung, mit einem nicht gerade geringen
Preis und zwischen den einzelnen Plasmiden vergleichbaren Versuchsergebnissen, ist das
Plasmid pAmp nicht uneingeschränkt für das Schülerexperiment zu empfehlen.
[Inhaltsverzeichnis] [Vorher] [Anfang] [Nächste]