Betrachtet man die bei den durchgeführten Transformationsversuchen erzielten Ergebnisse (Tab. 19 - 22), so konnte gezeigt werden, daß mit den im Versuchsteil beschriebenen Methoden Transformationen erfolgreich durchgeführt werden können.
Nach Methode A, bei der für die Gewinnung kompetenter Zellen direkt von einem
Agarnährboden gepickte Bakterienkolonien ohne vorherige Proliferation in Flüssigkultur
bei 37 °C verwendet wurden, konnten Bakterienzellen mit allen verwendeten Plasmiden mit
Erfolg transformiert werden.
Von MICKLOS/ FREYER (1990) werden für Transformationen nach Methode A
Transformationseffizienzen zwischen 5 x 103 und 5 x 104 erwartet.
Bei insgesamt 25 durchgeführten Transformationen mit den Plasmiden pBR322 (Tab. 19), pAmp
(Tab. 21), pUC 18/ pUC 19 (Tab. 20) lagen bei 14 Transformationen die
Transformationseffizienz, z.T. sogar recht deutlich, über den von MICKLOS/ FREYER
angegebenen Werten. Es gab lediglich drei Transformationen mit dem Plasmid pBR322 (Tab. 19)
und eine mit dem Plasmid pUC 18 (Tab. 20), bei denen die Effizienzen unterhalb des
Erwarteten lagen. Darunter war auch eine Agarplatte, auf der eine 1/10-Verdünnung einer
Transformation mit dem Plasmid pUC 18 ausgestrichen wurde, worauf nach Inkubation keine
Kolonien zu finden waren. Bei den übrigen Transformationen lagen die
Transformationseffizienzen im angegebenen Rahmen.
Für Methode B, bei der die Bakterienzellen in einer Flüssigkultur bei 37 °C bis zu
einem bestimmten photometrisch gemessenen Extinktionswert bei einer festgelegten
Wellenlänge inkubiert und erst dann mit Kalziumchlorid behandelt werden, wurden nur die
Plasmide pBR322 und pUC 18 für die Transformation der Bakterienzellen herangezogen. Die
mit den beiden Plasmiden erzielten Transformationseffizienzen (Tab. 22) bewegen sich im
Rahmen der Erwartungen. MICKLOS/ FREYER (1990) geben für diese Methode
Transformationseffizienzen zwischen 5 x 104 und 5 x 106 Kolonien pro Mikrogramm Plasmid-DNA an. Diese
wurden in den nach dieser Methode durchgeführten Transformationen erreicht.
Lediglich in den Ansätzen 2-1 und 2-2 der in der Tabelle 22 angegebenen Transformationen
mit dem Plasmid pBR322 werden die Erwartungen unterschritten. Die für diese
Transformation verwendeten Bakterienzellen wurden tags zuvor kompetent gemacht und dann
für 24 Stunden in einem Eisbad im Kühlschrank verwahrt. Ein Vergleich mit den
Transformationseffizienzen aus Ansatz 1-1 und 1-2 der Tabelle 22 -dabei handelt es sich um
Transformationen mit direkt nach deren Herstellung verwendeten kompetenten Zellen- konnte
eine von DAGERT und EHRLICH (1979) angegebene Steigerung der Transformationseffizienz
nicht bestätigen.
Aufgrund der dürftigen Anzahl an Versuchsdurchführungen können die Aussagen von DAGERT
und EHRLICH allerdings nicht als widerlegt gelten. Die gewonnenen Ergebnisse zeigen aber
auch, daß die kompetenten Zellen bei sachgerechter Lagerung nicht sofort ihre Kompetenz
verlieren. Daraus kann gefolgert werden, daß sich der Transformationsschritt zeitlich
gesehen nicht unmittelbar an die Gewinnung kompetenter Zellen anschließen muß. Dadurch
stehen dem Lehrer in der Schule Planungsmöglichkeiten offen. Er ist für das Gelingen der
Transformation nach der Methode B nicht gezwungen, das gesamte Experiment, d.h.
Herstellung kompetenter Zellen und Transformationsschritt, an einem Tag durchführen zu
müssen, sondern kann es problemlos an zwei aufeinanderfolgenden Tagen stattfinden lassen.
Das ist gerade auch vor dem Hintergrund zu sehen, daß die Gewinnung kompetenter Zellen
nach Methode B sehr zeitintensiv ist und der zur Verfügung stehende Zeitrahmen für einen
Tag dadurch leicht überschritten werden kann. Allerdings ist die Gewinnung kompetenter
Zellen nach dieser Methode nicht nur sehr zeitintensiv, sondern es bedarf auch einer
relativ guten Geräteausstattung der Schule, die neben der für die Durchführung der
Schülerexperimente nötigen Grundausstattung auch über ein Wasserbad mit
Schütteleinrichtung und ein Photometer mit den dazugehörigen Materialien wie Küvetten
verfügen muß. Da man davon ausgehen muß, daß dieses nicht von jeder Schule geleistet
werden kann und der zeitliche Rahmen einer unterrichtlichen Doppelstunde allein durch die
Gewinnung der kompetenten Zellen beansprucht wird sowie keine bessere
Transformationseffizienz erreichbar ist als mit Methode A, kann nur eine bedingte
Empfehlung für die Verwendung im Schulexperiment ausgesprochen werden. Die schulische
Ausstattung und die verfügbare Zeit vorausgesetzt, ist die Methode B nur vor dem
Hintergrund zu empfehlen, daß mit der Gewinnung kompetenter Zellen zeitgleich
Untersuchungen zum Bakterienwachstum in einer Flüssigkultur gemacht werden sollen. Wegen
der nur bedingten Empfehlung dieser Methode für die Verwendung im Schulunterricht wurden
hiermit keine Transformationen mit den Plasmiden pUC 19 und pAmp durchgeführt.
Vergleicht man die Ergebnisse der Transformationen allerdings mit von HANAHAN (1983) angebenen Transformationseffizienzen von minimal 106 Kolonien pro µg Plasmid-DNA, so sind die erzielten Effizienzen als sehr gering zu bezeichnen. Allerdings ist dabei nicht zu vergessen, daß es beim hier vorgestellten Transformationsexperiment in erster Linie darum geht, den Schülern das Prinzip der Transformation nahe zu bringen und daß die dabei erzielten Effizienzen eine untergeordnete Rolle spielen. Andersherum ausgedrückt heißt das, daß es zunächst einmal nicht so wichtig ist, wieviele Kolonien sich auf der Agarplatte nach Inkubation befinden, sondern daß sich überhaupt Kolonien darauf befinden. Dieses konnte bis auf die im Ergebnisteil geschilderte Ausnahme gezeigt werden.
Der wesentlichste Vorteil bei der von MICKLOS/ FREYER (1990) aufgezeigten Methode A ist das äußerst einfache Verfahren zur Gewinnung kompetenter Zellen. Dieses ist nicht nur vom Zeitaufwand her sehr gering, sondern auch vom Geräteaufwand, da im Vergleich zur Methode B weder Photometer inklusive Zubehör wie Küvetten noch eine Zentrifuge für die Gewinnung kompetenter Zellen benötigt werden. Zeitlich gesehen kann das komplette Schülerexperiment zur Transformation nach Methode A, was die Gewinnung kompetenter Zellen und den eigentlichen Transformationsschritt beinhaltet, innerhalb einer unterrichtlichen Doppelstunde von 90 Minuten problemlos durchgeführt werden. Diese Zeit ist nicht einmal für die Herstellung der kompetenten Zellen nach Methode B ausreichend, da hierfür allein schon mindestens 140 Minuten benötigt werden. Das hängt nicht zuletzt mit der Inkubation der Bakterienzellen zu Beginn der Methode B nach dem oben beschriebenen Verfahren zusammen, wofür ca. 1,5 - 2 Stunden zu veranschlagen sind. Aus Zeitersparnis könnte der Lehrer die Flüssigkultur schon die entsprechende Zeit vorher ansetzen. Das hätte aber zur Folge, daß die Schüler nicht an allen Phasen des Experimentes teilnehmen können, was für das Verständnis des Versuchsablaufes und aus Motivationsgründen nicht unbedingt von Vorteil ist. Dieses Problem besteht bei der Methode A nicht, weshalb die Methode A gegenüber der Methode B im Schülerexperiment vorzuziehen ist.
Aus den erzielten Resultaten (Tab. 22), ob eine Ausprägungsphase und eine Inkubation
bei 37 °C für die Erzielung ausreichender Transformationseffizienzen notwendig sind,
läßt sich zweierlei folgern:
1. Eine Ausprägungsphase ist für das Erreichen akzeptabler Versuchsergebnisse nicht
zwingend notwendig.
Daß diese entbehrlich erscheint, hängt mit dem Umstand zusammen, daß das auf den
Agarplatten enthaltene Ampicillin nur auf wachsende bzw. sich teilende Bakterienzellen
wirkt. Das Ampicillin wirkt wie alle Penicilline durch die Bindung an eine spezifische
Gruppe von Enzymen, die für die Transpeptidierungsreaktionen des Mureins bei der
Ausbildung des Mureinsacculuses verantwortlich sind. Dieser kann dadurch nicht ausgebildet
werden, was letztendlich für die Bakterien tödlich ist.
2. Die Bakterien brauchen für ihr Wachstum nicht in einem Brutraum oder in einem
Wasserbad bei 37 °C inkubiert werden.
Das Bakterienwachstum wird zwar dadurch herabgesetzt, aber nicht unterbunden. Für Schulen
sind diese Ergebnisse sehr von Vorteil, da dadurch der für die Versuchsdurchführung
benötigte Geräteaufwand weiter zurückgefahren werden kann und dem Lehrer eine
zusätzliche zeitliche Option im Laufe der Versuchsdurchführung zur Verfügung steht. Der
allerdings verlängerte Zeitraum bis zur Auswertung der Agarplatten muß vom Lehrer bei
seiner zeitlichen Gesamtplanung berücksichtigt werden. Gleiches gilt natürlich für das
Ansetzen der Agarplatten, von denen später die Bakterienkolonien für die Gewinnung
kompetenter Zellen gewonnen werden sollen. Durch diese gerade aufgezeigten Modifikationen
an der Versuchsdurchführung ist der Geräte- bzw. Materialaufwand für die Durchführung
des Schülerexperimentes nach Methode A auf ein Minimum reduziert worden. Dadurch ist es
selbst Schulen mit einer eingeschränkten Geräte- und Materialausstattung möglich, das
Schülerexperiment zur genetischen Transformation durchzuführen, da neben den Verbrauchs-
und biologischen Materialien keine weiteren Utensilien benötigt werden.
Aus den angeführten Gründen wird das Transformationsexperiment nach Methode A eindeutig
gegenüber der Methode B favorisiert.
Auf speziellen Agarplatten kann bei einigen Plasmiden die Identifizierung von
transformierten E. coli-Zellen anhand der Färbung dieser Kolonien erfolgen. Die
Färbung beruht auf einem pH-Wert abhängigen Farbumschlag eines Indikators im Zuge einer
metabolischen Substratverwertung der Bakterienzelle. Das Substrat ist Laktose, ein
Disaccharid in b-1,4-glykosidischer Bindung, welches mit Hilfe
des Enzyms b-Galaktosidase von der Bakterienzelle in Glukose
und Galaktose gespalten wird. Die erfolgreich transformierte Bakterienzelle, die lediglich
in der Lage ist ein inaktives Enzym für die Substratverwertung zu synthetisieren, wird
durch einen auf dem spezieller Plasmide codierten Anteil des lacZ-Gens, das sogenannte a-Peptid, dazu befähigt, ein funktionelles Enzym herzustellen (a-Komplementation).
Ziel eigener Versuche sollte die Überprüfung der Durchführbarkeit solcher
Experimente für den Schulunterricht sein.
Hierbei wurden die im Lehrermanual zur phänotypischen Auswertung/ Identifizierung von Transformanten auf McConkey-Agarplatten Kapitel 5.5.1 dargestellten Materialien und Methoden verwendet. Bei den verwendeten Plasmiden handelt es sich um das zur a-Komplemantation befähigte Plasmid pUC 19 und um das Plasmid pBR322, das keine a-Komplementation bewirkt.
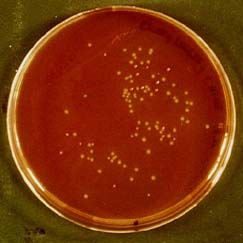
Die Abbildung 10 zeigt eine McConkey-Agarplatte nach 24stündiger Inkubation bei 37 °C. Auf ihr wurden E. coli K12 DH5a-Zellen aus zwei unverdünnten Transformationsansätzen im Verhältnis 1:1 ausplattiert. Der eine Transformationsansatz enthielt E. coli-Zellen, die mit dem Plasmid pBR322 transformiert wurden. Bei dem anderen Ansatz handelte es sich um E. coli-Zellen nach der Transformation mit dem Plasmid pUC 19. Es befinden sich neben weißen Kolonien auch rote Kolonien, deren Färbung allerdings in der Abbildung 10 nur relativ schwach zur Geltung kommt. Die optische Auszählung ergab ein Zahlenverhälnis von 75 weißen zu 22 roten Kolonien. Dieses Zahlenverhältnis ist auch in der Tabelle 24 dokumentiert. Dort befinden sich auch noch weitere Ergebnisse von anderen auf McConkey-Agarpaltten ausplattierten transformierten E. coli-Zellen.
 | Als große Abbildung |
|
Ansatz |
Plasmid |
Misch-verhältnis |
Plasmidmenge
|
Verdünnung |
Kolonien ges. |
Kolonien/ µg Plasmid |
|||
|
1 |
pUC 19 |
50 |
10 |
1 zu 10 |
7 (rot) |
7,1 x 103 |
|||
|
2 |
pUC 19 |
50 |
10 |
1 zu 10 |
2 (rot) |
2,0 x 103 |
|||
|
3 |
pBR322 |
50 |
10 |
1 zu 10 |
16 (weiß) |
1,6 x 104 |
|||
|
4 |
pBR322 |
Gemisch 1:1 |
50 |
10 |
unverdünnt |
75 (weiß) |
7,7 x 103 |
||
|
und pUC 19 |
50 |
10 |
unverdünnt |
plus 22 (rot) |
2,2 x 103 |
||||
|
5 |
pBR322 |
Gemisch 1:1 |
50 |
10 |
1 zu 10 |
3 (weiß) |
3,1 x 103 |
||
|
und pUC 19 |
50 |
10 |
1 zu 10 |
plus 2 (rot) |
2,0 x 103 |
||||
Bei den roten Kolonien handelt es sich um Bakterien, die in der Lage sind die in den
McConkey-Platten enthaltene Laktose zu verwerten. Bedingt ist das durch die oben
beschriebene Möglichkeit der a - Komplementation der hier
verwendeten
E. coli-Zellen mit dem Plasmid pUC 19. Die Rotfärbung hängt mit dem pH-Wert
abhängigen Farbumschlag eines Indikators zusammen, der sich im Agar der Platte befindet.
Dabei handelt es sich um Neutralrot, was bei pH > 6,8 nach
rot umschlägt. Dieser Wert wird bei der metabolischen Umsetzung von Laktose in den
betreffenden Bakterien unterschritten, wodurch die typische Färbung dieser Kolonien
zustande kommt. Das Plasmid pBR322 enthält nicht die entsprechende Sequenz zur a -Komplementation auf seinem Plasmid. Deshalb sind die mit diesem
Plasmid transformierten E. coli-Zellen nicht in der Lage Laktose zu
verstoffwechseln und haben aus dem Grund eine weißliche Farbe.
Die phänotypische Auswertung von Transformanten stellt eine Ergänzung zum Transformationsexperiment dar, welches durch die unterschiedlichen Färbungen für Schüler recht anschaulich ist und wodurch zusätzliche theoretische Aspekte wie z.B. die a -Komplementation und ihre Rolle für das sogenannte Screenen im Schulunterricht behandelt werden können.
[Inhaltsverzeichnis] [Vorher] [Anfang] [Nächste]